En esta última entrada del bloque de consejos para una correcta dilución (Consejos III) abordaremos algunos aspectos a tener en cuenta al realizar la mezcla entre el semen y el diluyente, y cómo debe realizarse la disminución de la temperatura de las dosis, además del por qué de algunos paradigmas que existen sobre este proceso.
Para proceder a la mezcla del diluyente y el eyaculado, existen 2 posibilidades, verter el diluyente en el semen o viceversa. Recientemente se publicó un artículo en el que se compararon ambas técnicas, tanto desde el punto de vista práctico, cómo de un posible efecto sobre diversos parámetros de calidad seminal (actividad mitocondrial, estado de la membrana, motilidad, …). Los resultados mostraron que no existen diferencias entre ambos métodos aunque sí se produce una mejor distribución y, por lo tanto, homogeneidad de la concentración espermática cuando se añade el semen al diluyente que a la inversa. Además, hacerlo de esta manera reduce o evita la formación de espuma y ahorra tiempo, ya que el volumen a verter es menor cuando se añade el semen, que el diluyente.
También en un primer experimento de este estudio, se comparó la adición del diluyente poniendo el tubo en la zona central del recipiente que contenía el eyaculado, o en contacto con la pared, y no se observaron diferencias en cuanto a la distribución de la concentración.
Otro gran paradigma de la dilución de los eyaculados ha sido el grado de dilución, parámetro que relaciona el volumen del eyaculado, la concentración, el nº de dosis y el volumen de diluyente a añadir. Cuando se tienen eyaculados de gran volumen, pero con una baja concentración, el nº de dosis a producir será bajo y el volumen de diluyente a añadir será pequeño, tendremos un grado de dilución bajo (relación volumen diluyente-volumen eyaculado). Por el contrario, cuando se trate de eyaculados muy concentrados con bajo volumen, con los que se pueda hacer un elevado nº de dosis, el volumen de diluyente será muy alto y el grado de dilución será elevado.
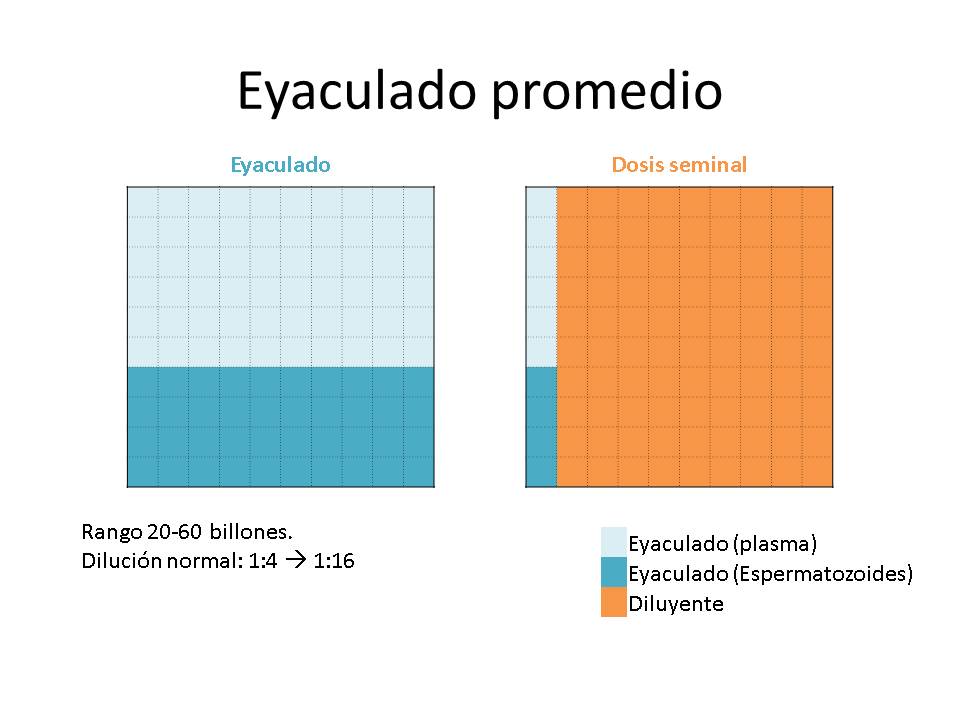
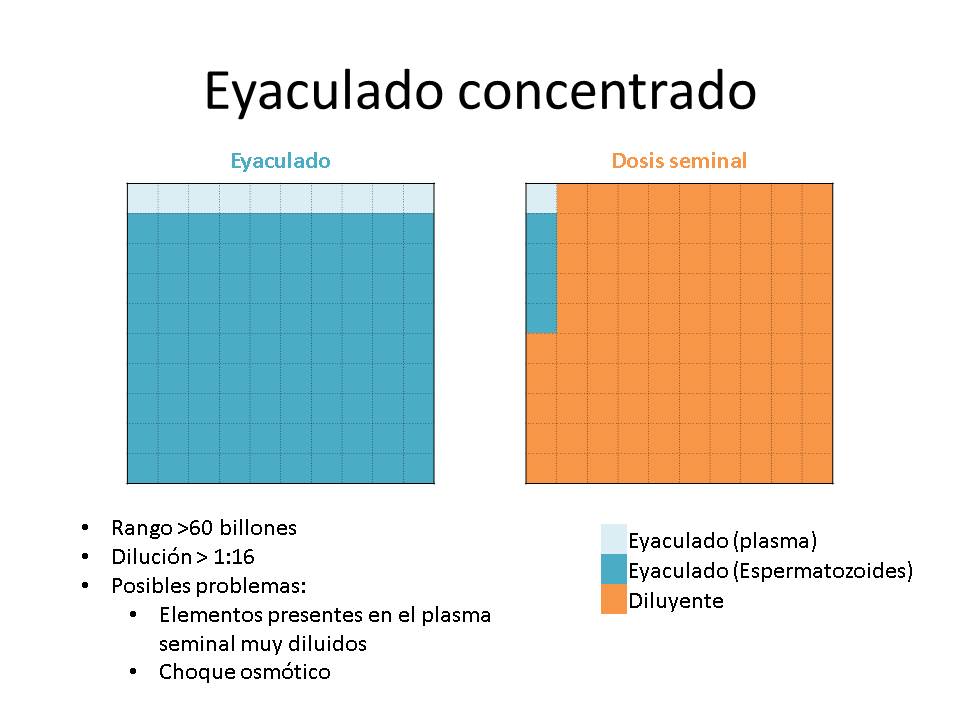
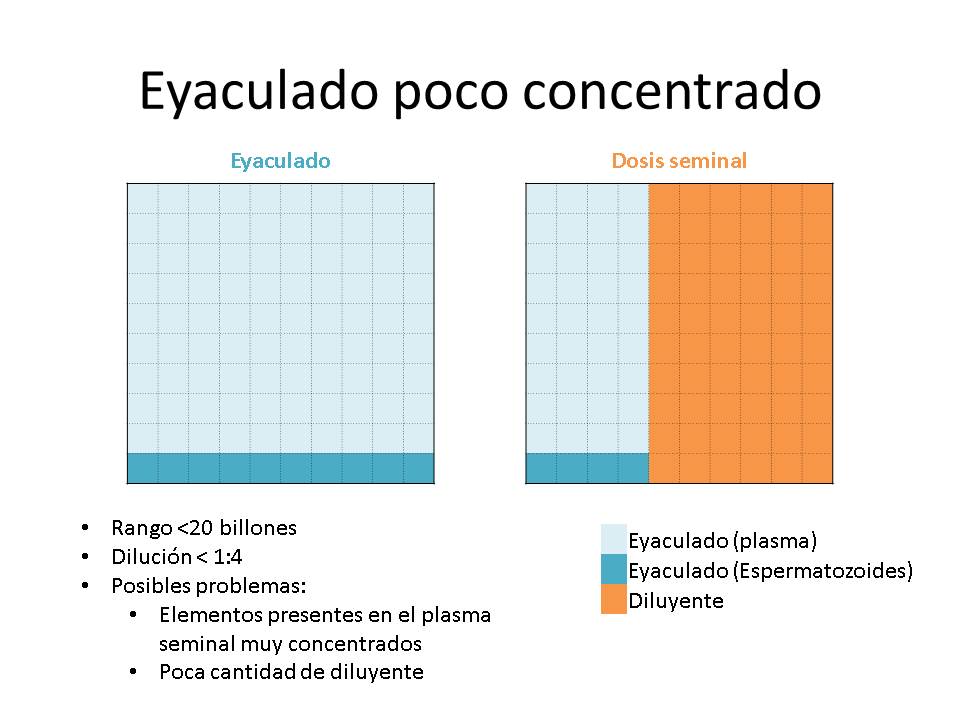
Generalmente los límites del grado de dilución han sido establecidos >1:4 y <1:16
El efecto negativo del grado de dilución venía dado por que las dosis resultantes tendrían una mayor o menor cantidad de plasma seminal, y esto podría tener un efecto negativo en la conservación de las dosis seminales, y por el hecho de que los espermatozoides podrían sufrir un choque osmótico.
Hoy día sigue sin estar claro el efecto biológico que tiene de una mayor o menor cantidad de plasma seminal en las dosis, ya que éste tiene componentes que favorecen la conservación espermática, tanto como otros que promueven la capacitación espermática, además de la gran variabilidad que hay en su composición entre machos, diferentes épocas del año y dentro de un mismo animal (ya que varía su composición a lo largo de su vida útil).
Respecto al posible choque osmótico al entrar en contacto el eyaculado con el diluyente, hace años, los diluyentes utilizados tenían una composición distinta a los actuales, con una osmolalidad más alta (Ej: Kiev 425 mOsm/kg; Zorlesco 240 mOsm/kg) de la propia del eyaculado (290-300 mOsm/kg, tolerando entre 250-380 mOsm/kg, pero siendo mejor cuando más cercana esté de la fisiológica). Esto podía provocar, en eyaculados muy concentrados a los que se debía añadir un volumen elevado de diluyente, que la presión osmótica final de las dosis seminales fuera elevada, comprometiendo su calidad y conservación.
Sin embargo, los diluyentes actuales presentan osmolalidades similares a la del eyaculado. Por ello, el grado de dilución es un parámetro que con los años ha ido perdiendo disminuyente en importancia.
Finalmente, una vez que se ha procedido a la dilución y el envasado de las dosis, tal y como comentamos en la primera entrada, se debe proseguir con la disminución de la temperatura, hasta llegar a la temperatura de almacenamiento, sin verse comprometida la integridad de la membrana espermática, por todos los factores explicados en la entrada “Consejos I”.
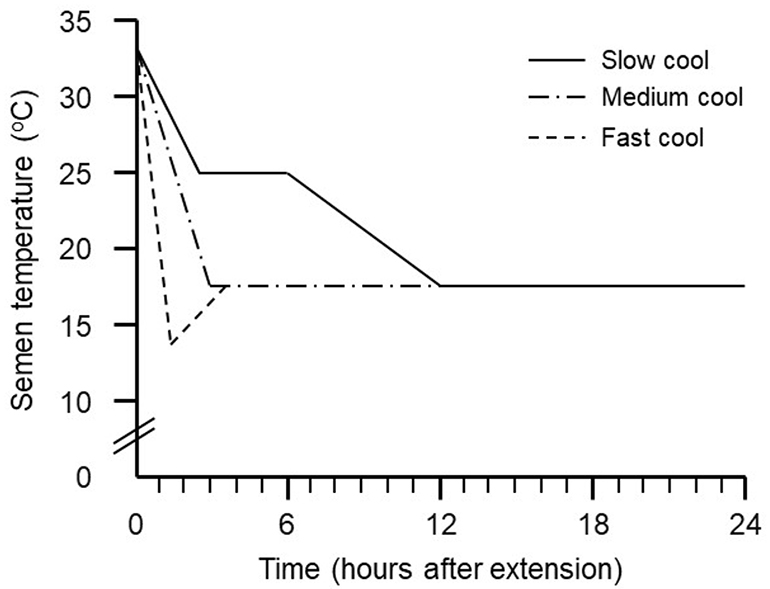
Recientemente se publicó un artículo en el que se evaluaban 3 rampas diferentes de disminución de temperatura:
- Enfriamiento lento: Hasta alcanzar la temperatura del laboratorio (25ºC) y después se introduce en la cámara de conservación
- Enfriamiento medio: Directamente a la cámara de conservación
- Enfriamiento rápido: A 10ºC durante 2 horas y después a la cámara de conservación
Fuente: https://www.nationalhogfarmer.com/animal-health/cool-way-control-semen-quality
Se evaluaron diferentes parámetros de calidad seminal como la motilidad, y la fertilidad y prolificidad en granja. Se obtuvieron unos resultados inferiores tanto para los parámetros in vitro como in vivo, con las dosis que habían sido sometidas a la curva de enfriamiento rápido frente a las de medio y lento.
Hoy día hay CIAPs, que realizan la introducción de las dosis seminales directamente en la cámara de conservación, justo después del envasado, para favorecer un descenso de temperatura más rápido.
Para el enfriamiento y conservación de las dosis, se utilizan bien cámaras de conservación tipo nevera, cámaras frigoríficas modificadas para trabajar a una temperatura de 15-17ºC, o salas acondicionadas con equipos de aire acondicionado que permitan mantener la temperatura objetivo. Todo ello se puede complementar con ventiladores que favorezcan el intercambio de calor y por tanto un descenso de temperatura más rápido.
Con esta última entrada damos por finalizado el bloque de “Consejos para una correcta dilución”.
En blogs posteriores haremos referencia a “Consejos para un correcto envasado de las dosis”.
Esperamos que la información os sea útil y, por otra parte, estamos muy agradecidos por vuestro interés.
Bibliografía utilizada en los 3 bloques de «Consejos para la dilución»:
- Centurion, F., Vazquez, J. M., Calvete, J. J., Roca, J., Sanz, L., Parrilla, I., … Martinez, E. A. (2003). Influence of Porcine Spermadhesins on the Susceptibility of Boar Spermatozoa to High Dilution1. Biology of Reproduction, 69(2), 640–646. https://doi.org/10.1095/biolreprod.103.016527
- Gadea, J. (2003). Review: semen extenders used in the artificial insemination of swine. Spanish Journal of Agricultural Research, 1(2), 17. https://doi.org/10.5424/sjar/2003012-17
- Schulze, M., Ammon, C., Schaefer, J., Luther, A. M., Jung, M., & Waberski, D. (2017). Impact of different dilution techniques on boar sperm quality and sperm distribution of the extended ejaculate. Animal Reproduction Science, 182(February), 138–145. https://doi.org/10.1016/j.anireprosci.2017.05.013
- Drobnis EZ, Crowe LM, Berger T, Anchordoguy TJ, Overstreet JW, Crowe JH. Cold shock damage is due to lipid phase transitions in cell membranes: A demonstration using sperm as model. J Exp Zool 1993;265:432–7. doi:10.1002/jez.1402650413.
- Parks JE, Lynch D V. Lipid composition and thermotropic phase behavior of boar, bull, stallion, and rooster sperm membranes. Cryobiology 1992;29:255–66. doi:10.1016/0011-2240(92)90024-V.
- Schulze M, Henning H, Rüdiger K, Wallner U, Waberski D. Temperature management during semen processing: Impact on boar sperm quality under laboratory and field conditions. Theriogenology 2013;80:990–8. doi:10.1016/j.theriogenology.2013.07.026.
- López Rodríguez A, Rijsselaere T, Vyt P, Van Soom A, Maes D. Effect of dilution temperature on boar semen quality. Reprod Domest Anim 2012;47:30–3. doi:10.1111/j.1439-0531.2011.01938.x.
- Waberski D, Petrunkina AM, Töpfer-Petersen E. Can external quality control improve pig AI efficiency? Theriogenology 2008;70:1346–51. doi:10.1016/j.theriogenology.2008.06.006.
- Rodríguez AL. Fresh boar semen : quality control and production. 2012.
- Petrunkina AM, Volker G, Weitze K-F, Beyerbach M, Töpfer-Petersen E, Waberski D. Detection of cooling-induced membrane changes in the response of boar sperm to capacitating conditions. Theriogenology 2005;63:2278–99. doi:10.1016/j.theriogenology.2004.10.008.
- Schmid S, Henning H, Oldenhof H, Wolkers WF, Petrunkina AM, Waberski D. The specific response to capacitating stimuli is a sensitive indicator of chilling injury in hypothermically stored boar spermatozoa. Andrology 2013;1:376–86. doi:10.1111/j.2047-2927.2013.00045.x.
- Ausejo R. Results of Interactive survey. XII Int. Tech. Meet. Magapor. Challenges Futur. swine Reprod., Zaragoza, Spain: 2017.
- Riesenbeck A, Schulze M, Rüdiger K, Henning H, Waberski D. Quality Control of Boar Sperm Processing: Implications from European AI Centres and Two Spermatology Reference Laboratories. Reprod Domest Anim 2015;50:1–4. doi:10.1111/rda.12573.
- https://www.nationalhogfarmer.com/animal-health/cool-way-control-semen-quality