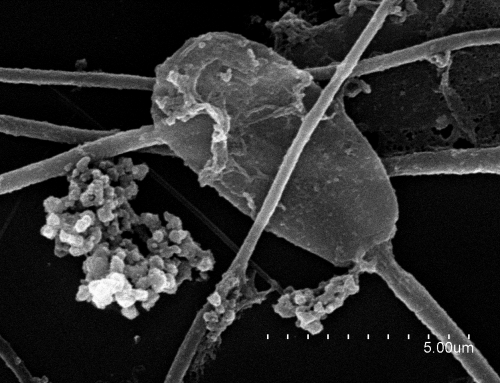
La inclusión de marcadores en el análisis de una muestra seminal para inseminación artificial podría resultar de gran utilidad.
Sin embargo, a la hora de testar sementales, hay que tener en cuenta que una buena calidad seminal, determinada por valoración de la motilidad o integridad de la membrana plasmática, no siempre garantiza una buena capacidad fecundante.
Algunos estudios han relacionado la existencia de espermatozoides con alteraciones iniciales en la membrana plasmática, mitocondrias y ADN no sólo con bajos resultados de fertilidad en algunas especies, sino también con problemas en el desarrollo posterior de los embriones. Así pues, sería recomendable el estudio de estos marcadores en el análisis de la calidad seminal de nuevos sementales.
Puesto que el daño en el ADN sería uno de los últimos escalones en la cadena degenerativa del espermatozoide, a veces, sementales con fertilidad comprometida pasarían desapercibidos al analizar únicamente el ADN. Es por esto que sería necesario un estudio complementario de su estado mitocondrial y de la membrana plasmática del mismo con tinciones específicas no detectables mediante otras técnicas de uso más común. Es por esto que sería necesario un estudio complementario de su estado mitocondrial y de la membrana plasmática del mismo con tinciones específicas no detectables mediante otras técnicas de uso más común, como ocurre en los sistemas CASA de análisis seminal. Para esto resulta de gran utilidad la citometría de flujo.
Para esto resulta de gran utilidad la citometría de flujo.
Citometría es un término genérico que se aplica a cualquier tecnología que es usada para la medición, recuento, comparación u otra caracterización de células que se encuentran suspendidas en un fluido (flujo) y atraviesan un finísimo tubo transparente sobre el que incide un delgado rayo de luz láser.
La citometría de flujo representa un método rápido, objetivo y cuantitativo de análisis de células, núcleos, cromosomas, mitocondrias u otras partículas en suspensión. Es un método analítico multiparamétrico que permite la medición rápida de ciertas características físicas y químicas de células o partículas suspendidas en un medio líquido que producen una señal de forma individual al interferir con una fuente de luz.
Una de las características analíticas más importantes de los citómetros de flujo es su capacidad de medir múltiples parámetros celulares como el tamaño, forma y complejidad y, por supuesto, cualquier componente celular o función que pueda ser marcada con un fluorocromo.
Las señales luminosas detectadas se transforman en impulsos eléctricos. Estos se amplifican y se convierten en señales digitales que procesa un ordenador posteriormente.
Gracias a su gran especificidad es capaz de distinguir entre varias poblaciones diferentes (espermatozoides, bacterias,…). Pero la principal característica de la citometría de flujo, como ya se ha mencionado, es que puede ofrecer información simultánea de varios parámetros de cada uno de los espermatozoides analizados y la relación entre los parámetros estudiados de varios espermatozoides. Todo ello a gran rapidez (4000 espermatozoides por segundo), lo que nos permite tener una información muy objetiva y de gran tamaño muestral, además de conocer el funcionamiento interno del espermatozoide.
El inconveniente que presenta la citometría de flujo es su elevado precio, por lo que no se suele usar para la producción de dosis seminales, sino más bien en investigación y como herramienta para evaluar la capacidad fecundante de los verracos. Por otra parte, debido a su complejidad se necesita personal cualificado y con experiencia para su uso e interpretación de resultados.
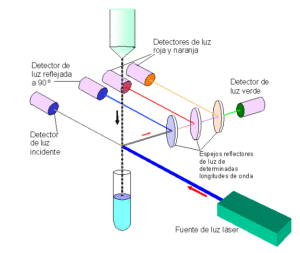
Fuente: UNIVERSIDAD DE MADRID
Para el análisis con citometría la muestra espermática se encuentra en suspensión, de modo que hacemos pasar dichas células a través de una cámara sobre la que incide un haz de luz de una longitud de onda concreta “Láser”. Pasan a velocidad constante de varios miles por segundo y dentro de un flujo laminar.
Los datos generados se analizan estadísticamente mediante varios programas (software) específicos que nos dan una gran información acerca de sus características intrínsecas y / o extrínsecas, así como estructurales y / o funcionales de los espermatozoides.
Lo más complejo de la citometría es saber qué queremos analizar, cómo estudiarlo (fluorocromo necesario, protocolo de detección, etc..) y cómo interpretar los resultados.
Y esto es todo por hoy. La semana que viene nuestro departamento de I+D+i Biotecnología nos aportará la segunda parte de su exposición relativa a la CITOMETRÍA DE FLUJO.