¿Podemos realizar pool de las muestras para disminuir los costes del análisis?.
La respuesta no es fácil, está claro que, si tomamos muestras de semen o saliva, la concentración del virus en los primeros días post-infección va a ser muy baja y disminuiremos aún más la precisión y sensibilidad del muestreo, por lo que algunos autores nos recomiendan no realizar pool de este tipo de muestras. Por el contrario, en muestras de sangre, ya sea colectadas con vacutainer o con hisopo, además de tener una presencia de viremia temprana, también tendrán una mayor carga viral, por ello son válidas para la realización de pool. En todo caso, el número de muestras a mezclar en un pool no debe ser mayor de 3-5. Siempre tenemos que pensar en el trinomio practicidad-coste-beneficio. Está claro que hacer un pool de 5 muestras de sangre será lo más práctico y que nos ayudará a disminuir costes, pero tenemos que tener en cuenta que perderemos sensibilidad en la detección (Tabla 1).
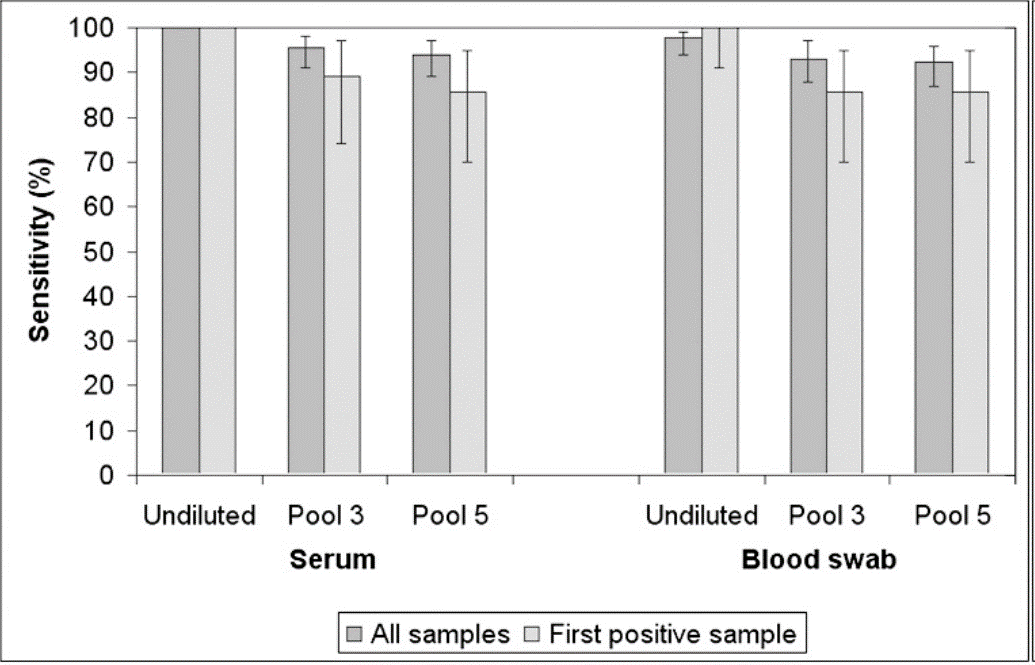
Tabla 1: efecto de la realización de pool en la sensibilidad de la RT-PCR.
Fuente: Rovira et al. J. Vet. Diagn. Invest. (2007)
Una vez hemos determinado todos los parámetros, tipo de muestra, método de toma de muestra, realización de pool o no, falta determinar la frecuencia de testaje de los animales. Para ello, podemos confiar en modelos matemáticos que nos determinaran la tasa de detección de los diferentes porcentajes de testeo según la frecuencia y el nº de animales. Para esto hay diferentes calculadoras virtuales con las que, añadiendo el censo de nuestro centro, el tipo de muestra que utilizamos y la frecuencia de testeo nos dará la probabilidad de detección de la entrada del virus en la explotación (Imagen 1).
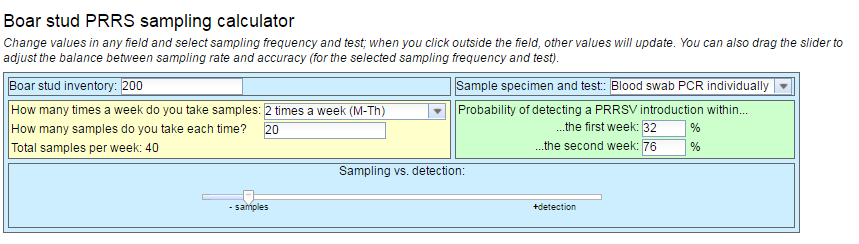
Imagen 1: calculadora
Fuente: AASV 2018
Para conseguir la máxima seguridad en el centro se deberían de testar los verracos con muestras sanguíneas en PCR en cada extracción, de esta manera conseguimos maximizar al 100% la sensibilidad de la prueba, pero entendemos que en muchas ocasiones no es práctico a nivel de campo por tiempo, coste, o rechazo de los animales, por eso tenemos que decidir qué nivel de seguridad y riesgo aceptamos en nuestra explotación para calcular el número de animales a testear. También habrá que decidir si ese cálculo lo queremos hacer de cada día de extracción o a nivel semanal, mensual, etc. pues eso modificará los costes. Lo que sí que parece claro es que los verracos de líneas maternas deberían ser testados con la mayor frecuencia posible, ya que el efecto económico de la diseminación del virus puede llegar a ser mucho mayor que en la de los finalizadores.
En la tabla 2, podemos ver una simulación en un centro de 200 verracos, entre probabilidad de detección en la primera y segunda semana post infección y el coste de la realización del test conforme se aumenta el nº de muestras.
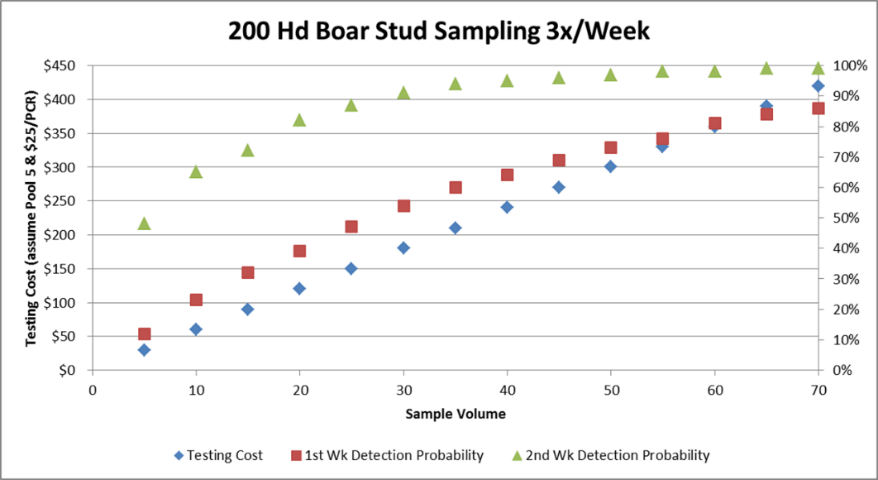
Tabla 2: Clayton Johnson, Carthage Veterinary Services. ITM 2017
En lo referente al coste asociado por dosis, es complicado dar un valor monetario, ya que esto dependerá de múltiples factores, como la disponibilidad que tengamos de laboratorios en nuestra zona, nº de muestras y tipo de test a realizar, lo eficientes que seamos al producir (obtener un mayor nº de dosis por eyaculado disminuirá el coste asociado) …
En conclusión, hay múltiples estrategias para monitorizar/diagnosticar la entrada de PRRS en un centro de inseminación. Cada una de ellas aporta mayor o menor sensibilidad y conlleva un mayor o menor coste, dependerá de la forma de trabajo, del uso de los animales (uso interno vs venta de dosis), y del riesgo de entrada del virus en el CIA, por lo que es importante que todos los estratos de producción y trabajadores sean conscientes de la importancia de mantener la bioseguridad y de realizar una correcta monitorización para evitar problemas.
BIBLIOGRAFÍA
Guérin B., Pozzi N. Viruses in boar semen: detection and clinical as well as epidemiological consequences regarding disease transmission by artificial insemination. Theriogenology. 2005 Jan 15; 63(2):556-72.
Pepin B.J., Kittawornrat A., Liu F., Gauger P.C., Harmon K., Abate S., Main R., Garton C., Hargrove J., Rademacher C., Ramirez A., Zimmerman J. Comparison of specimens for detection of porcine reproductive and respiratory syndrome virus infection in boar studs. Transbound Emerg Dis. 2015 Jun; 62(3):295-304.
Reicks, D. L., C. Munoz-Zanzi, and K. Rossow, 2006b: Sampling of adult boars during early infection with porcine reproductive and respiratory syndrome virus for testing by polymerase chain reaction using a new blood collection technique (bloodswab method). J. Swine Health Prod. 14, 258–264.
Reicks D., Muñoz-Zanzi C., Mengeling W., Christopher-Hennings J., Lager K., Polson D., Dee S., Rossow K. Detection of porcine reproductive and respiratory syndrome virus in semen and serum of boars during the first six days after inoculation. J Swine Health Prod. 2005; 14:35–41.
Rovira, A., T. Clement, J. Christopher-Hennings, B. Thompson, M. Engle, D. Reicks, and C. Munoz-Zanzi, 2007a: Evaluation of the sensitivity of reverse-transcription polymerase chain reaction to detect porcine reproductive and respiratory syndrome virus on individual and pooled samples from boars. J. Vet. Diagn. Invest. 19, 502–509.
https://www.3tres3.com/articulos/limitaciones-de-la-pcr-en-el-diagnostico-del-prrs_40023/
https://www.3tres3.com/articulos/retos-en-el-diagnostico-de-prrsv_35536/