El virus del PRRS es un patógeno que genera un gran dolor de cabeza en el sector porcino, no sólo debido a su variabilidad genética y su alta tasa de mutación que dificulta su control, si no también debido a las grandes pérdidas económicas que ocasiona la entrada del virus en una explotación.
Una de las etapas productivas en las que es de especial importancia es en los centros de inseminación (CIA) ya que las dosis seminales producidas serán utilizadas en numerosas granjas de reproductoras. Por lo tanto, es responsabilidad del CIA el instaurar y llevar a cabo protocolos eficaces de bioseguridad para impedir la entrada de PRRSv y la diseminación dentro de la explotación. Estas medidas tienen un efecto sinérgico, es decir, el resultado de la suma de las acciones es la que brinda la protección óptima y se comportan como una cadena, si se rompe un eslabón, el conjunto de ellas se verá afectado. En este consejo hablaremos de una de ellas, la monitorización y diagnóstico rutinario del virus PRRS dentro de los centros de inseminación. Para ello, es clave que establezcamos los siguientes puntos: muestreo, frecuencia y técnica de diagnóstico a utilizar.
Para monitorizar los animales de un centro de inseminación necesitamos las técnicas de mayor sensibilidad que detecten la infección en su estadio más temprano. El método que nos ofrece estas dos características es la RT–PCR (Tabla 1), ya que amplifica exponencialmente el genoma del virus y es capaz de detectar pequeñas cantidades del mismo en la muestra, utilizando cebadores específicos. El problema que plantea este virus es su gran diversidad genética, lo que dificulta tener un método de PCR único para detectar todas las variantes.
Una vez determinada la prueba a realizar, falta decidir cuál es la muestra a analizar (sangre, suero, semen…) y cuál es la frecuencia de testaje (en cada extracción, mensual, en presencia de sintomatología…).
La transmisión de PRRS a través de semen depende de múltiples factores y es bastante difícil de predecir, creyéndose que la cepa del virus y su virulencia tienen un rol importante. También depende de factores individuales del hospedador que determinan la cantidad de virus en el semen. Esto nos lleva a observar casos en los que el virus nunca se detecta en semen y otros casos donde podemos detectarlo durante largos periodos de tiempo. Otras vías de dispersión además del semen pueden ser saliva, heces, orina y secreciones nasales. Debemos comentar que no sólo animales con síntomas pueden trasmitir el virus, hay casos en los que animales infectados con PRRS han negativizado a pruebas de PCR en sangre y semen, y en un análisis post-mortem se ha hallado el virus acantonado en las tonsilas, pudiendo quedar como reservorios del virus.
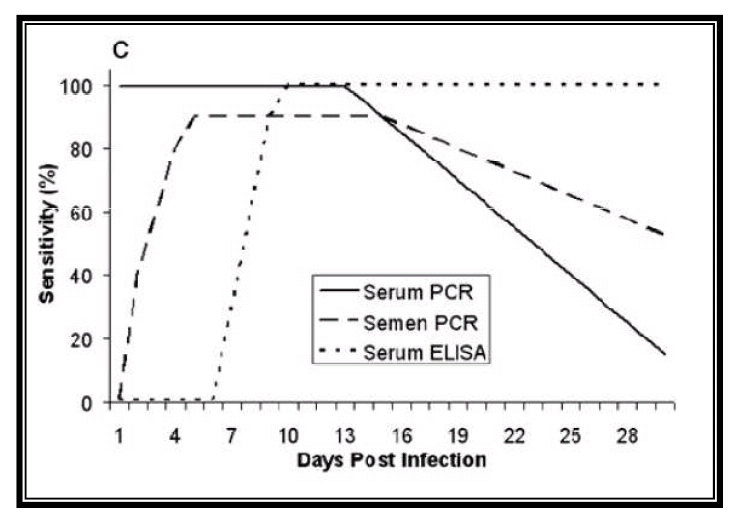
Tabla 1: Sensibilidad de detección de PRRS mediante PCR.
Fuente: Rovira et al. J. Vet. Diagn. Invest. (2007)
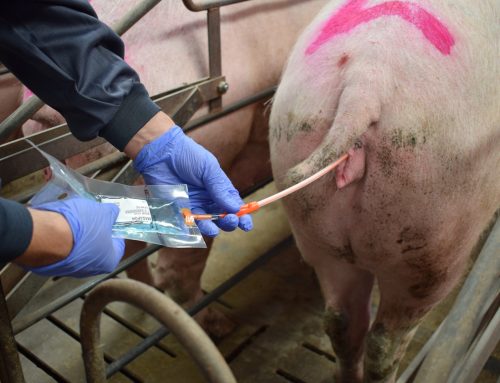
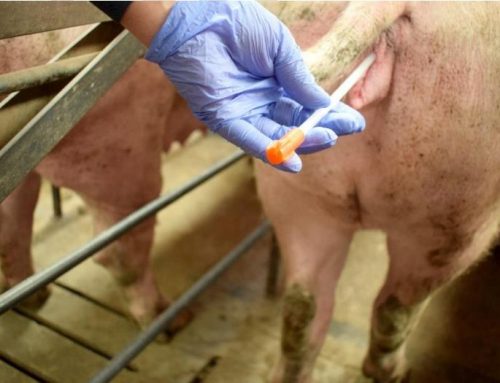
Hay diversos estudios dónde se ha comparado la eficacia y sensibilidad de detección del virus PRRS en diferentes muestras, siendo la muestra que ha presentado una mayor sensibilidad en la detección la sangre o suero, con una sensibilidad 50-100 veces mayor que la detección en semen. Como hemos comentado antes, la presencia del virus en el semen es muy variable y la llegada del virus al aparato reproductor es mediante la diseminación orgánica, debiendo atravesar por tanto la barrera hemato-testicular. Por ese motivo, si lo que queremos es detectar rápido la presencia del virus en nuestro centro de inseminación utilizando el semen como muestra, podemos estar llegando demasiado tarde. La principal ventaja que tiene el uso de semen es que es el método menos invasivo y que mayor facilidad presenta para la obtención. Otra ventaja es que nos aseguramos de que todas las dosis que producimos y que llegan a granja están libres de PRRS.
El testaje sobre muestra de suero nos va a dar una mayor sensibilidad, pero tiene el inconveniente de ser una técnica más invasiva, que debe realizarse en la vena yugular, vena safena o coccígea. La toma de la muestra se aconseja que se realice durante la extracción del eyaculado, aunque esto puede provocar que el verraco se baje del potro, no completando la eyaculación y entorpeciendo el trabajo en el centro. Realizar esta técnica sobre los animales 1 o 2 veces por semana no es práctico, por eso, una alternativa al sangrado habitual sería la propuesta en el estudio realizado por Darwin Reicks en 2006, en el que valoró el uso de la venopunción en oreja (vena auricular) y posterior humedecimiento de un hisopo para obtener una muestra de sangre. Este método mostró una correlación de detección del virus por PCR del 90% a las 24h post infección y del 100% una vez pasadas las 48h de la infección. De las 60 muestras tomadas, con hisopo 59/60 dieron positivo, mientras que con sangrado habitual 60/60 positivas (Tabla 2). Este estudio concluye que la toma de muestras con hisopos y su posterior introducción en un medio de transporte compuesto por suero salino es una alternativa al tradicional sangrado, siendo más efectiva y fiable que otro tipo de muestras como semen y saliva.
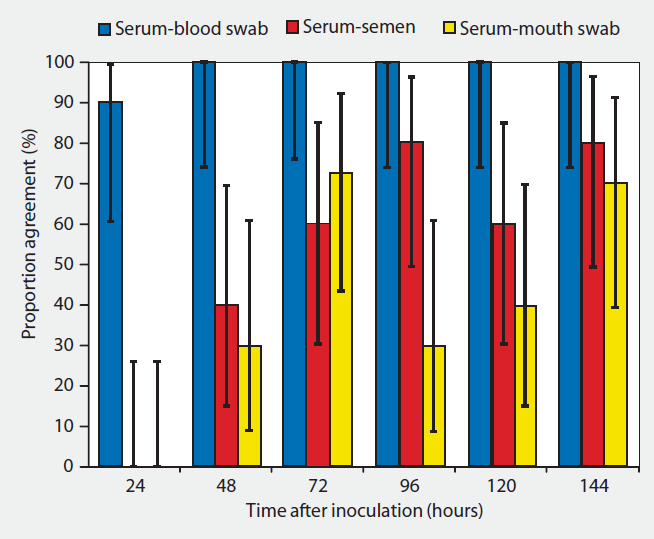
Tabla 2: proporción de correlación y 90% de intervalo de confianza para los resultados de PCR realizados sobre muestras de sangre, hisopado de sangre, semen y saliva.
Fuente: Reicks D. L. Muñoz-Zanzi C. (2006)
La detección más temprana ocurre debido a que el virus puede estar presente y en una cantidad detectable en sangre en las primeras 24 post infección, mientras que la detección en otros fluidos como esperma o saliva pueden variar entre las 48h y los 14 días, esto, como se ha comentado anteriormente, va a depender en gran medida del individuo y de la cepa del virus. En la Tabla 3 podemos ver otro ejemplo de resultados en cuanto al porcentaje de positivos detectados según la estrategia de muestreo que llevemos a cabo.
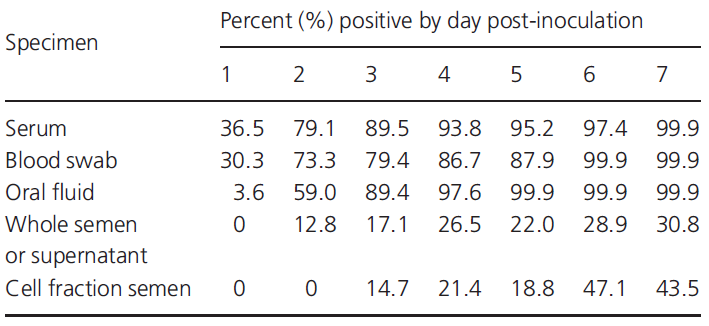
Tabla 3: detección temprana de PRRS por PCR en función del espécimen y día post-inoculación.
Fuente: Pepin B. J. et. al. (2015)
En cuanto a la estrategia de realizar un control sintomático estricto, como es el control de temperatura rectal (> 39.5ºC), toses, disminución de la calidad y volumen seminal etc. No es una estrategia recomendable debido a que, con frecuencia, la infección pasa clínicamente desapercibida, llegando incluso a no estar correlacionado el aumento de temperatura rectal con el resultado positivo a PRRS (Tablas 4 y 5). Por lo tanto, el testaje debe llevarse a cabo siempre que se presenten síntomas, pero no como única estrategia de detección del virus.

Tabla 4. Infección PRRS en verracos: signos clínicos después de una infección natural o experimental
Fuente: B. Guerin and N. Pozzi, 2005. Theriogenology

Tabla 5. PRRS en verracos. Efecto en la calidad seminal
Fuente: B. Guerin and N. Pozzi, 2005. Theriogenology
Sea cuál sea el método de muestreo que elijamos, deberemos buscar un equilibrio en cuanto al bienestar animal y facilidad de trabajo de los empleados sin comprometer el objetivo final que es producir dosis desde centros libres de PRRS.